Vand møder vi overalt i hverdagen. Det er ikke kun den drik, vi har brug for hver dag, men også en kemisk substans med bemærkelsesværdige egenskaber. Men vidste du, at vandets kemiske egenskaber har afgørende betydning for livet på Jorden?
Uden vand kunne der ikke foregå reaktioner i vores celler, ingen planter ville vokse, og Jorden ville være et helt andet sted.
💧Fakta om vand:
- Molekylstruktur: Vand består af to brintatomer (H) og ét oxygenatom (O), kemisk formel H₂O.
- Dipolmolekyle: Vand har en ulige ladningsfordeling – oxygen er let negativt, mens brintatomerne er let positive.
- Hydrogenbindinger: Disse bindinger mellem vandmolekyler er ansvarlige for mange egenskaber, såsom høj overfladespænding.
- Aggregattilstande: Vand findes som væske, fast stof (is) og gas (damp).
- Densitetsanomali: Is er mindre tæt end flydende vand, hvorfor det flyder på vandet.
- Neutral pH-værdi: Rent vand har en pH-værdi på 7, det er hverken surt eller basisk.
- Opløsningsmiddel: Vand er et stærkt opløsningsmiddel og kan opløse mange stoffer, som salt og sukker.
Denne artikel forklarer, hvorfor vand er så specielt, og hvilke kemiske og fysiske egenskaber der gør det unikt. Du vil lære, hvorfor vand har en høj densitet, hvorfor is flyder, og hvad hydrogenbindingerne betyder.
Vi ser også på, hvordan temperaturen påvirker vand, og hvorfor vand er et så effektivt opløsningsmiddel. Vand er altså meget mere end bare en almindelig væske – det er et ægte kemisk vidunder!

Vandmolekylet H₂O i detaljer
For at forstå vandets særlige egenskaber kan vi først se nærmere på selve vandmolekylet. Et molekyle er den mindste enhed af en kemisk forbindelse, som stadig har stoffets typiske egenskaber. Det består af atomer, der er forbundet gennem kemiske bindinger. I tilfælde af vand består et molekyle af to hydrogenatomer (H) og et oxygenatom (O). Derfor har vand den kemiske formel H₂O.
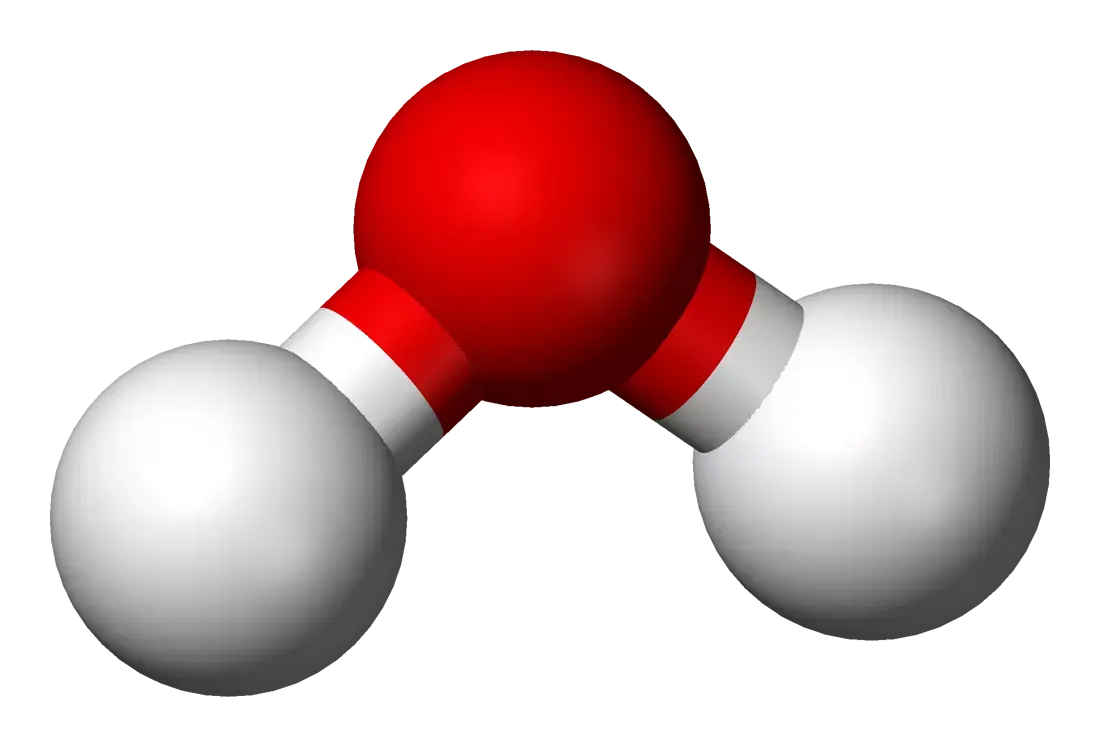
Men hvad gør vandmolekylet så særligt? Vand er et såkaldt dipolmolekyle. Det betyder, at ladningen i molekylet ikke er jævnt fordelt. Oxygenatomet tiltrækker de negativt ladede elektroner stærkere, hvilket giver det en let negativ ladning. Hydrogenatomerne er derimod let positivt ladede.
Denne ladningsfordeling gør, at vandmolekyler opfører sig som små magneter, der tiltrækker hinanden.
Denne egenskab, at vand er et dipolmolekyle, er ansvarlig for mange specifikke kemiske reaktioner og egenskaber, såsom dets evne til at opløse stoffer og danne hydrogenbindinger mellem vandmolekyler.
Aggregattilstande – vand som væske, is og damp
Vand kan forekomme i tre forskellige former, de såkaldte aggregattilstande: fast, flydende og gasformig. Som is er vand fast, ved stuetemperatur er det flydende, og ved 100 °C fordamper det og bliver til damp. Disse faseovergange er af stor betydning for mange naturlige processer på Jorden.
Når vand fryser, omdannes det ved 0 °C til is. Vandmolekylerne bevæger sig langsommere, indtil de danner en fast struktur. Når vand opvarmes til kogepunktet på 100 °C, bliver det til vanddamp. I denne tilstand bevæger vandmolekylerne sig så hurtigt, at de frigøres fra hinanden og stiger op i luften.
Vandets densitetsanomalie betyder, at vand har sin højeste densitet ved 4 °C. I modsætning til de fleste stoffer er fast vand (is) mindre tæt end flydende vand. Derfor flyder is på vand. Denne anomalie sikrer, at søer og floder fryser fra toppen om vinteren, mens vandet nedenunder forbliver flydende, hvilket muliggør overlevelse for vandlevende organismer i kolde områder.
En særlig egenskab ved vand er dets densitetsanomalie. Normalt har faste stoffer en højere densitet end væsker, men med vand er det omvendt: Is har lavere densitet end flydende vand, og derfor flyder is på vandet. Denne anomalie er afgørende for livet på Jorden, fordi søer og floder om vinteren ikke fryser helt til. Isen ligger på overfladen, hvilket holder temperaturen under islaget relativt stabil og giver mange organismer mulighed for at overleve.

Kemiske og fysiske egenskaber ved vand
Vand har særlige kemiske og fysiske egenskaber, som spiller en vigtig rolle både i hverdagen og på Jorden. Farve, lugt og smag af vand er i ren tilstand næsten ikke mærkbare. Det er farveløst, lugtfrit og næsten altid smagsløst, da der ikke er opløst yderligere molekyler eller ioner i det. Smagen af vand kan dog variere, hvis der er opløst mineraler eller andre molekyler, såsom ilt.
En anden vigtig egenskab ved vand er dets densitet. En liter vand vejer cirka et kilogram, hvilket skyldes den særlige opbygning af vandmolekylerne. Denne densitet er afgørende for mange naturlige processer, såsom cirkulationen af vand på Jorden.
Derudover har vand en høj varmekapacitet. Det betyder, at det kræver meget energi at opvarme vandet. Denne egenskab er vigtig for klimaet, fordi vand kan lagre store mængder varme, hvilket hjælper med at stabilisere temperaturerne på Jorden og skabe et miljø, hvor liv kan trives.
Et andet fysisk fænomen er vandets overfladespænding. De stærke hydrogenbindinger mellem vandmolekylerne skaber en spænding på overfladen. Denne høje overfladespænding gør det muligt, at insekter som vandløbere kan bevæge sig hen over vandet uden at synke.

Et andet vigtigt kemisk aspekt ved vand er dets pH-værdi. pH-værdien angiver, hvor sur eller basisk en opløsning er. Rent vand har en pH-værdi på 7, hvilket betragtes som neutralt. Det betyder, at vand hverken er surt eller basisk. Denne værdi opstår, fordi vand altid indeholder en lille mængde ioner som H₃O⁺ (hydronium) og OH⁻ (hydroxid). pH-værdien kan dog ændre sig, hvis andre mineraler er opløst i vandet. For eksempel bliver vand let surt, hvis kuldioxid fra luften opløses i det. pH-værdien spiller en vigtig rolle i kemien, da den påvirker mange kemiske reaktioner, især i naturlige vandmiljøer og i kroppen.
Vand som opløsningsmiddel
Vand er et ekseptionelt stærkt opløsningsmiddel og kan opløse mange forskellige stoffer. Denne egenskab skyldes vandmolekylets særlige struktur. Vand er et såkaldt polært molekyle, hvilket betyder, at det har to modsatte elektriske ladninger.
Oxygenet i vandmolekylet tiltrækker de negative elektroner mere, mens hydrogenatomerne er positivt ladede. Dette gør, at vandmolekyler kan omslutte og opløse andre polære stoffer ved at adskille de positive og negative ioner i disse forbindelser.
I hverdagen ser vi dette, når vi opløser sukker i te eller blander salt i vand. I begge tilfælde fungerer vandmolekylerne som usynlige hjælpere, der adskiller stofferne i deres bestanddele. Denne egenskab er også vigtig i naturen: I drikkevand er mange essentielle næringsstoffer opløst, som planter kan optage. Også i vores krop spiller vand en central rolle, da det transporterer næringsstoffer og er nødvendigt for mange kemiske reaktioner.
Hydrogenbindinger – vandets superkraft
En af vandets største styrker ligger i dets hydrogenbindinger. Men hvad er hydrogenbindinger egentlig? Disse særlige bindinger opstår, når de let positivt ladede hydrogenatomer i et vandmolekyle tiltrækkes af de negativt ladede oxygenatomer i et nabomolekyle. Molekylerne forbinder sig næsten som usynlige magneter. Bindingerne er svagere end egentlige kemiske bindinger, men stærke nok til at forklare mange af vandets unikke egenskaber.
Et eksempel på betydningen af hydrogenbindinger er overfladespændingen. Bindingerne gør, at vandmolekylerne på overfladen holder tæt sammen. Derfor kan insekter som vandløbere gå på vandet uden at synke. Et andet eksempel er vandets høje kogepunkt. Det kræver meget energi at bryde hydrogenbindingerne og omdanne vand til damp. Uden disse bindinger ville vand koge ved meget lavere temperaturer.
Denne usynlige kraft er afgørende for mange af vandets kemiske og fysiske egenskaber, som vi møder i hverdagen – både i naturen og når vi varmer vores drikkevand op.
Vand og elektricitet
Om vand leder strøm afhænger af, hvilke andre forbindelser der er opløst i det. Rent vand, altså vand uden urenheder, leder strøm meget dårligt, fordi der næsten ikke er frie ioner, som kan transportere elektriske ladninger.
Til gengæld leder vand fra hanen elektricitet langt bedre, fordi det ofte indeholder opløste salte og mineraler som natrium, calcium og magnesium. Disse ioner gør vandet ledende og spiller en vigtig rolle i mange kemiske processer.

Disse opløste mineraler frigiver ioner, som gør det muligt for elektricitet at flyde gennem vandet. De kemiske og fysiske egenskaber af vand ændrer sig derfor betydeligt, afhængigt af hvilke stoffer der er opløst i det.
Et endnu tydeligere eksempel er havvand. Havvand indeholder langt flere opløste salte end almindeligt drikkevand, især natriumchlorid (bordsalt). Dette gør havvand særligt ledende. De mange ioner i havvandet muliggør en stærkere strømførsel sammenlignet med normalt drikkevand, hvilket viser, hvor stor indflydelse opløste stoffer har på vandets egenskaber.
Denne høje saltkoncentration påvirker også andre fysiske egenskaber, såsom vandets densitet – havvand er tættere end ferskvand, hvilket har betydning for vandets densitetsanomalie.
I kemien er vandets evne til at lede elektrisk strøm en vigtig faktor i mange reaktioner. Denne evne kan forstærkes ved tilsætning af visse stoffer, hvilket understreger vandets rolle som både opløsningsmiddel og leder i kemiske processer.
Uden vand på Jorden ville livet, som vi kender det, ikke være muligt, da mange biologiske og kemiske processer afhænger af vandets unikke egenskaber.
Hvis du vil lære endnu mere om vandets kemi og dets mange egenskaber, kan en privatunderviser i kemi være en stor hjælp. Med individuel vejledning kan du få forklaringer tilpasset dit niveau, stille alle de spørgsmål, du har, og arbejde med praktiske eksperimenter. En privatunderviser kan også hjælpe dig med at forstå komplekse emner som vandets dipolstruktur, hydrogenbindinger og dets rolle som opløsningsmiddel på en mere interaktiv og motiverende måde.
Sammenfat med AI















