Vand er grundlaget for alt liv på Jorden. Over 70 procent af Jordens overflade består af vand, og det spiller en central rolle i utallige naturlige processer. Uden vand ville livet, som vi kender det, ikke være muligt.
Men hvad gør vand så særligt? Det er ikke kun det, vi drikker som vand, men også et vigtigt kemisk stof, der påvirker vores klima, natur og krop.
De vigtigste fakta om vand 💡
- Vand dækker over 70 % af Jordens overflade og er grundlaget for alt liv.
- Det består af to hydrogenatomer (H) og et oxygenatom (O) – kemisk formel H₂O.
- Vand findes i tre tilstande: flydende, fast (is) og gasformig (vanddamp).
- Det er et dipol-molekyle med ujævn ladningsfordeling, hvilket giver det en høj overfladespænding.
- Is er mindre tæt end flydende vand, derfor flyder det – denne tæthedsanomali sikrer overlevelsen af levende organismer om vinteren.
- Vand har en neutral pH-værdi på 7, hvilket gør det ideelt til mange kemiske processer.
Vand består af vandmolekylet H₂O, som består af to hydrogenatomer (H) og ét oxygenatom (O). Denne forbindelse giver vand dets unikke egenskaber og gør det til en afgørende byggesten for livet.
Uanset om det forekommer som vanddamp, flydende vand eller is – vand findes i alle tre tilstande og spiller en central rolle i naturen.
I denne artikel vil vi se nærmere på, hvad vand præcist består af, hvordan det er opbygget, og hvorfor det er uundværligt for livet på Jorden.

Hvad består vand af?
Vand er en enkel, men fascinerende forbindelse: H₂O. Denne kemiske formel betyder, at hvert vandmolekyle består af to hydrogenatomer (H) og ét oxygenatom (O). Samspillet mellem disse atomer giver vand dets særlige egenskaber og gør det til et af de vigtigste stoffer på Jorden.
De to hydrogenatomer er hver især bundet til oxygenatomet gennem såkaldte kovalente bindinger. Det betyder, at atomerne deler elektroner for at danne en stabil forbindelse.
Denne type kemisk binding i vand gør, at vandmolekylet er stabilt og kan forekomme i naturen i mange tilstande – som flydende vand, is eller vanddamp.
Oxygenatomets rolle i vandmolekylet er særlig vigtig, da det tiltrækker elektronerne stærkere end hydrogenatomerne. Dette skaber en ulige ladningsfordeling, hvilket gør vandmolekylet til en dipol. Denne egenskab medfører særlige vekselvirkninger mellem vandmolekylerne, som blandt andet er ansvarlige for vandets høje overfladespænding og mange andre af dets karakteristiske egenskaber.
Denne simple, men effektive kemiske struktur gør vand til en essentiel byggesten for livet og sikrer, at det er uundværligt i mange naturlige processer.
Vandmolekylet i detaljer
Vandmolekylet H₂O består af to hydrogenatomer og ét oxygenatom. Disse tre atomer er arrangeret, så de danner en vinkel på cirka 104,5 grader. Denne vinkel er afgørende for vandmolekylets betydning i naturen. Den særlige form skaber en ulige fordeling af elektrisk ladning, hvilket gør vandmolekylet til en dipol.
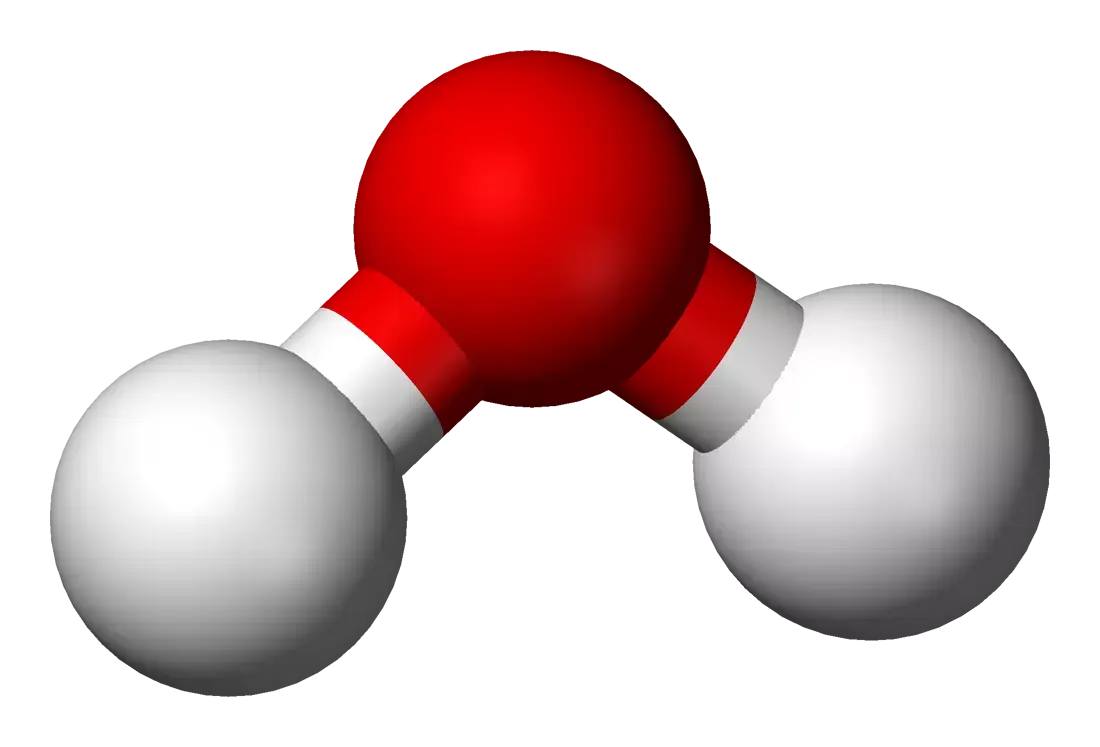
Oxygenatomet i vandmolekylet tiltrækker de negative elektroner stærkere, så det får en let negativ ladning. De to hydrogenatomer er derimod let positivt ladede.
Denne ladningsfordeling gør, at molekylerne opfører sig som små magneter – de tiltrækker hinanden og danner de såkaldte hydrogenbindinger.
Betydningen af vandets dipolkarakter forklarer mange af dets særlige egenskaber, såsom den høje overfladespænding og evnen til at opløse mange stoffer. Uden denne specielle opbygning ville vand ikke kunne eksistere i forskellige tilstande eller spille sin vigtige rolle i naturen.

Vand som stabil kemisk forbindelse
Vandets stabilitet skyldes dets unikke kemiske struktur og de stærke bindinger mellem molekylerne. Selve vandmolekylet holdes sammen af kovalente bindinger, hvor de to hydrogenatomer deler deres elektroner med oxygenatomet. Denne forbindelse sikrer, at grundstrukturen af vand er meget stabil.
En yderligere betydning for vandets stabilitet har hydrogenbindingerne. Disse bindinger dannes mellem de let positivt ladede hydrogenatomer i ét vandmolekyle og det let negativt ladede oxygenatom i et nærliggende vandmolekyle. Selvom disse bindinger er svagere end de kovalente bindinger, bliver de meget effektive i store mængder. De sørger for, at molekylerne hænger tæt sammen og giver vand dets særlige egenskaber, såsom høj overfladespænding og højt kogepunkt.
Takket være hydrogenbindingerne forbliver vand stabilt og kan eksistere i forskellige tilstande som flydende, fast (is) eller gasformigt (damp). Denne stabilitet er også vigtig for grundvand og oceaner, hvor store mængder vand opretholder deres struktur over lang tid.
Særlige kemiske og fysiske egenskaber ved vand
Vand har unikke kemiske og fysiske egenskaber, der gør det uundværligt for livet. En af disse egenskaber er den høje varmekapacitet. Det betyder, at vand kan optage og lagre store mængder energi uden at ændre sin temperatur markant. Denne egenskab stabiliserer jordens klima og spiller en afgørende rolle i atmosfæren og havene.
Kemisk formel: H₂O (to hydrogenatomer, ét oxygenatom)
Dipol-molekyle: Ulig ladningsfordeling, oxygen negativt, hydrogen positivt
Hydrogenbindinger: Stærke bindinger mellem vandmolekyler
Høj varmekapacitet: Vand lagrer meget varme uden at ændre temperatur markant
Overfladespænding: Høj spændkraft på vandoverfladen, gør det muligt for insekter at gå på vand
Densitetsanomali: Is er mindre tæt end flydende vand, derfor flyder is
Opløsningsmiddel: Vand opløser mange stoffer som salte og sukker på grund af sin polaritet
pH-værdi: Rent vand har en neutral pH på 7
Aggregattilstande: Fast (is), flydende (vand), gasformig (damp) ved normale temperaturer på Jorden
En yderligere vigtig egenskab ved vand er overfladespændingen. På grund af hydrogenbindingerne tiltrækker vandmolekylerne hinanden stærkt, især ved vandoverfladen. Dette gør det muligt for små insekter som vandløbere at bevæge sig hen over vandet uden at synke. Den høje overfladespænding illustrerer, hvor stærkt molekylerne i vand hænger sammen.
Et andet fænomen er vandets densitetsanomali. Normalt bliver stoffer tættere i fast form, men vand er anderledes: Is har lavere tæthed end flydende vand og flyder derfor. Denne egenskab er afgørende for livet i søer og floder, da vandet under isen forbliver flydende, hvilket sikrer overlevelse for fisk og andre organismer i kolde perioder.
Kemisk set er vand en neutral substans med en pH-værdi på 7, hvilket betyder, at det hverken er surt eller basisk. Denne neutralitet er vigtig for mange naturlige processer. pH-værdien kan dog variere i atmosfæren eller i drikkevand, når andre elementer som kuldioxid eller mineraler opløses. Alligevel forbliver rent vand en central grundsten for livet og for kemiske reaktioner i naturen.
Vand som livets byggesten
Vand er en grundlæggende byggesten i livet og spiller en central rolle i næsten alle biologiske processer. Uden vand kunne de essentielle funktioner i livet ikke finde sted. Det fungerer ikke kun som medium for kemiske reaktioner, men også som transportmiddel for næringsstoffer, affaldsstoffer og andre vitale forbindelser.
I vores celler, som overvejende består af vand, muliggør det transport af næringsstoffer og understøtter de kemiske processer, der er nødvendige for energiproduktion og cellevækst. Uden vand ville de komplekse stofskifteprocesser ikke være mulige, hvilket viser, hvor uundværligt vand er for alt liv.
Et andet eksempel er transporten af næringsstoffer i levende organismer. I menneskekroppen bruges vand til at transportere næringsstoffer via blodet til cellerne og samtidig fjerne affaldsstoffer. Vand spiller også en central rolle i reguleringen af kropstemperaturen, da det via fordampning kan aflede varme fra kroppen.
Vand udgør cirka 60 procent af menneskekroppen og er ligeledes afgørende for planter, da det optager næringsstoffer fra grundvandet og transporterer dem gennem planten. Uden vandets evne til at opløse og transportere næringsstoffer ville livet, som vi kender det, ikke være muligt.
Vand og økosystemer
Vandet på Jorden er en uundværlig del af økosystemerne og spiller en central rolle både i terrestriske og akvatiske habitater. I terrestriske økosystemer er vand ofte den begrænsende faktor for produktiviteten. Planter har brug for vand til vækst og stofskifte, og nedbør fylder både grundvand og overfladevand, der fungerer som drikkevand for dyr. Uden vand kunne mange biologiske processer ikke finde sted, og biodiversiteten ville være stærkt begrænset.
I akvatiske økosystemer, især i havene, er mængden af opløste næringsstoffer som fosfater, kvælstofforbindelser og kuldioxid (CO₂) afgørende. Disse næringsstoffer er essentielle for væksten af plankton og andre organismer. Her bliver vandets betydning tydelig, da størstedelen af Jordens biomasse findes i havene.
Vandets densitetsanomali er særligt vigtig for livet i vandmiljøer. Den sikrer, at søer om vinteren ikke fryser helt til, og at livet under isen kan overleve. I dybe søer medfører densitetsanomalien desuden om foråret og efteråret en omrøring af vandet, som understøtter kredsløbet af næringsstoffer og ilt, hvilket er afgørende for et sundt økosystem.

Hvis du gerne vil lære endnu mere om vand, dets kemiske egenskaber og betydning i naturen, kan en privatunderviser på Superprof være en stor hjælp.
Her får du individuel vejledning, hvor du kan stille spørgsmål, få forklaringer og dybere indsigt, skræddersyet til dit niveau og dine interesser.
Privatundervisning gør det muligt at gå i dybden med emner som molekylstruktur, vandets rolle som opløsningsmiddel eller dets betydning i økosystemer, og hjælper dig med at forstå teorien på en praktisk og engagerende måde.
Sammenfat med AI















